CGMS——无酶葡萄糖检测
-
1. 研究现状
基于GOx/GDH的酶生物传感器有着良好的选择性和灵敏度,但酶交联固定的过程中,不可避免的会引发酶的失活,且固定酶的量无法准确控制,批量重复性难以保障,再者,由于酶的活性与温度、pH和湿度等外界条件影响较大,也很难与MEMS加工工艺结合,难以降低规模化成本。因此,发展无酶葡萄糖传感器成为当前葡萄糖检测领域的又一研究热点。
-
2. 无酶葡萄糖检测原理
无酶葡萄糖传感器通过葡萄糖分子在活性电极表面发生直接电催化氧化反应而对其进行检测,电极表面的电催化性能是影响葡萄糖氧化及基于此的葡萄糖检测的主要因素,这类电极主要有:(1)金属及其氧化物,如Pt、Au、Pd等贵金属,过渡金属Ni、Cu及其氧化物等;(2)双金属,如合金、金属-金属氧化物和金属氧化物-金属氧化物等;(3)碳材料,如碳纳米管、石墨烯、石墨烯氧化物及它们与金属的复合物等。
无酶葡萄糖氧化的机理还未被清晰的认识,目前学术界公认的电极表面电催化模型有Pletcher模型及Burke模型。
2.1 Pletcher模型
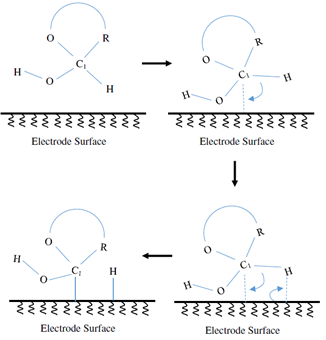
Pletcher认为葡萄糖的氧化过程始于葡萄糖分子在电极表面的吸附,从而使葡萄糖分子与电极之间形成化学键,使电催化氧化得以进行,与此同时,葡萄糖分子中与半缩醛(hemiacetal)结构中的碳原子相连的氢原子被剥离后,又立刻绑定在了相邻的位点。绑定在电极上的葡萄糖分子因氧化产生的状态变化导致葡萄糖—金属交互行为的改变,降低了葡萄糖—金属的绑定力度,导致了葡萄糖分子的沉积。由于电极表面和葡萄糖分子形成并打破了他们之间的电化学催化过程,因此需要一种适中的绑定力度,以便有益于吸附与沉积过程。
2.2 Burke模型
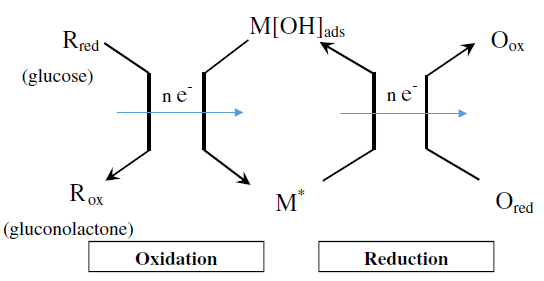
Burke模型又称为Incipient Hydrous Oxide Adatom Mediator (IHOAM),“初级含水氧化物吸附原子介体”理论。Burke观察到电极表面的活性金属原子具有较低的晶格稳定性和较高的反应活性。这些原子受前期的单层氧化后形成了一种水性氧化层OHads,这一层被视为在电极表面氧化葡萄糖的介体,如图所示。M∗是还原态金属的吸附位点,M[OH]ads是吸附了羟基的氧化态金属;首先,葡萄糖分子吸附在金属原子(M)表面,从而在M表面形成一层OHads膜,最后M[OH]ads将表面吸附的葡萄糖氧化成葡萄糖酸。
-
3. 研究进展
无酶型葡萄糖传感器的性能通常依赖于电极表面的纳米结构,近年来,许多结构特殊、性能优异的新型纳米材料的出现,为无酶电化学葡萄糖传感器的制备提供了广阔的技术条件,出现了许多令人欣慰的进展。但正如葡萄糖在各类电极上氧化机理仍存争议,要想实现其商业化,仍有一系列问题有待解决,如大多数无酶型传感器的测试条件仍然是磷酸缓冲溶液或NaOH溶液,而人体血液中所含物质非常复杂,如电活性物质、药物、蛋白质、其他糖类、氯离子和乙醇等,这些干扰物能在电极表面产生强烈吸附,影响传感器的灵敏度、选择性和稳定性;多数无酶型葡萄糖传感器还存在一些局限,如贵金属材料的线性响应范围较宽,却存在灵敏度低,容易“中毒”而逐渐失活的问题;过渡金属材料及其氧化物的灵敏度非常高,但其线性范围却很窄,抗干扰能力也相对较弱。

从上表可见,以贵金属、合金、金属氧化物以及它们之间或它们与碳纳米管、石墨烯为代表的无酶电化学葡萄糖传感器,虽然多数在纳米技术的作用下,通过制成多孔、定向生长纳米线等结构,大大提高材料表面比表面积,能获得优异的灵敏度,但或多或少都存在易受Cl-干扰、线性检测范围窄等问题,通过合成合金,多种材料复合或与导电高分子、碳纳米管或石墨烯复合等方法,可在一定范围内,提高抗干扰能力、扩大线性检测范围,有些甚至于接近于临床应用的要求,但单纯通过制备各种结构形态各异的纳米材料来解决这类问题仍然面临巨大的挑战。
